Pour éffectuer un
calcul de caractérisation, les 5 données suivantes sont
obligatoires dans EquiWin :
- Température
(en °C)
- pH
- TAC
(ou alcalinité, sous forme de °F, de mg de HCO3/L ou
de mg de CaCO3/L)
- Calcium
(sous forme de °F, de mg/L, de milliéquivalents/L ou
de mg de CaCO3/L)
- Résidu
Sec (ou RS, sous forme de
résidu sec à 180 °C, ou de conductivité
en µS [micro Siemens] ou encore de
résistivité [en Ohm.cm]).
La température, le pH, la conductivité (ou résistivité) doivent être plutôt mesurés in situ afin d’éviter toute altération due au transport des prélèvements (risque de dégazage, d’échanges avec l’air ambiant). Ceci est d’autant plus vrai pour les eaux douces et/ou très agressives.
Les concentrations en chlorures et sulfates
sont à renseigner si l’on souhaite calculer l’
indice
de Larson.
Nota : les concentrations en chlorures et sulfates sont à
renseigner en mg/l.
Température.
la température (en °C) intervient dans les calculs de
pK1, pK2 et pKs, et donc dans ceux du pHs, IS et CO2 libre.
(voir sur ce sujet le fichier equilibre.pdf),
et finalement influe sur les paramètres de l'équilibre
calco-carbonique.
pH.
le pH représente le potentiel d'hydrogène, c'est
à dire la concentration en ions hydrogène
exprimé par le cologarithme de
H+ (-H+).
D'une façon générale l'eau est :
- "acide" si le pH est inférieur à 7
- "basique" si le pH est supérieur à 7
- "neutre" si le pH est égal à 7
Mais il est à noter que le
pH d'équilibre calco-carbonique ne correspond pas au pH
de neutralité électronique, soit pH 7. On peut avoir un
pH d'équilibre qui se trouve être un pH acide ou basique
du point de vue électronique.
Nota : sur le graphique Hallopeau, il représente le point
figuratif de l'eau considérée.
TAC.
le TAC ou Titre Alcalimètrique Complet
représente la teneur de l'eau bicarbonates
(hydrogénocarbonates HCO3-), carbonates
(CO32-) et en alcalis libres (ions OH-), et
liés aux ions positifs Ca2+, Mg2+,
Na+ et K+.
Le TAC est aussi appelé "alcalinité".
Nota : le Titre Alcalimétrique simple TA (non utilisé
ici) mesure la teneur de l'eau en alcalis libres et en carbonates
alcalins (liés au sodium Na+ et potassium
K+). Dans les eaux naturelles, le TA ne peut
apparaître que si leur pH est supérieur ou égal
à 8,3 (TA = 0 si pH <=8.3).
La répartition des ions constitutifs de l'alcalinité
peut être calculée à partir des valeurs
respectives de TA et TAC.
Le Titre Temporaire ou dureté temporaire,
appelé aussi souvent dureté carbonatée
représente les anions carbonates et
hydrogénocarbonates, essentiellement de calcium et
magnésium (anions qui disparaissent après
ébullition de l’eau). On pourra trouver quelquefois le
terme de " dureté alcaline ".
La dureté totale d’une eau ou Titre
Hydrotimètrique TH correspond à la quantité
totale de l’eau en calcium et magnésium.
- Si le TAC est inférieur
au TH (TAC<TH), cette dureté carbonaté est
égale au TAC.
- Si TAC = TH, il ne peut y avoir
d'autres sels de Ca²+ ou Mg²+ autres que des
bicarbonates, et dans ce cas la dureté carbonaté
représente également le TAC.
- Si TAC > TH : dans ce dernier cas, l'eau renferme des bicarbonates alcalins, sodium ou potassium (Na+ ou K+) et la dureté carbonaté est égale au TH.
Le Titre Permanent ou dureté permanente
(appelé aussi dureté non carbonatée ou non
alcaline) est la concentration en sels de calcium et
magnésium, autres que les carbonates ou
hydrogénocarbonates, donc due principalement à la
présence d’anions sulfates, chlorures et nitrates.
Elle est donc la différence entre la dureté totale (TH)
et la dureté temporaire.
Par définition, la dureté totale TH est égale
à la somme des duretés permanentes et temporaires. La
dureté totale est donc aussi égale à la somme
des duretés carbonatée et non carbonatée.
Par conséquent, on a : dureté permanente = TH -
TAC, si TAC±TH (ce qui est le cas presque général
des eaux naturelles).
Par convention, ces titres, qui ne se rapportent pas à un ion
spécifique, sont toujours exprimés en degré
français.
Le tableau suivant permet de déduire les ions
définissant l’alcalinité d’une eau à
partir des valeurs de TA et TAC (cas
général) :
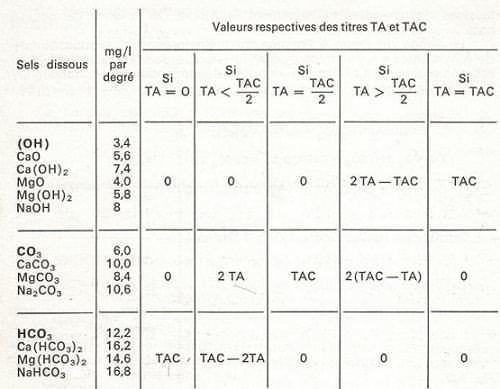
Calcium.
Le calcium ou dureté calcique exprime la concentration globale
d’une eau en sels de calcium quel que soit l’anion
associé. On l'appelle aussi quelquefois Titre Calcique
[TCa] de l’eau.
On parle de même de dureté magnésienne (ou Titre
Magnésien, TMg ) uniquement dû aux sels de
magnésium.
La dureté totale d’une eau ou Titre Hydrotimètrique TH correspond donc à la quantité totale de l’eau en calcium et magnésium. Une eau dure est une eau qui laisse des dépôts incrustants de carbonate (générateurs de tartre) lorsqu’elle est chauffée. Cette caractéristique se traduit également par la difficulté du savon à mousser.
On classe généralement les eaux de la manière suivante :
- TH < 10 °F : eaux très douces
- 10 °F < TH < 20 °F : eaux douces à moyennement douces
- 20 °F < TH < 30 °F : eaux dures
- 30 °F < TH : eaux
très dures
Rappel de la notion de milliéquivalent et de
degré.
Dans les analyses, la concentration des différents
éléments est presque toujours exprimée en
milligramme par litre (mg/L) ou en microgramme par litre
(mg/L)
pour les éléments traces (1
m g/l
= 10-3 mg/l = 10-6 g/l).
On trouve aussi parfois, spécialement dans les documents
provenant des U.S.A, une expression de la concentration en ppm
(partie par million). En toute rigueur, le ppm se rapporte à
une concentration poids pour poids. Mais il n'y a pas une grande
erreur en l'assimilant au mg/l, ou encore au g/m³, lorsqu'il
s'agit de solutions extrêmement diluées comme l'eau
naturelle. L'expression en mg/L n'est pas toujours commode pour
contrôler les résultats d'une analyse. Il faut dans ce
cas la remplacer par le milliéquivalent (g) par litre qui se
note mé/l ou encore meq/l.
Rappel : par définition, l'équivalent-gramme est
constitué par le quotient de la masse atomique du corps simple
considéré, sur son nombre de charge électrique
(anciennement la valence) .
Par exemple, la masse atomique du calcium étant d'environ 40
et ce corps étant bivalent (Ca2+),
l'équivalent-g vaut donc 40/2, soit 20. Une solution à
1 g/l de calcium renfermera 1/20 = 0,05 équivalent/L, soit 50
meq/l. Si l'élément considéré est
monovalent, par exemple le sodium Na+ de masse 23,
l'équivalent-g vaudra donc 23/1 = 23 g/L.
Cette notation présente
plusieurs avantages :
Elle permet la sommation de tous les éléments d'une
analyse, ce qui conduit à évaluer simplement sa
minéralisation,= balance ionique et elle permet le calcul
immédiat des concentrations en sels.
Dans la chimie de l'eau, on a
souvent besoin de connaître non pas le détail des
différents ions présents, mais plutôt la somme de
certains d'entre eux (Ca2+, Mg2+, carbonates,
bicarbonates, etc.). Il s'agit par exemple des titres : dans ce cas,
une mesure exprimée en mg/l n'aurait évidemment aucune
signification, alors que mé/l permet une évaluation
immédiate. Cependant, une vieille habitude a été
conservée par les traiteurs d'eau français qui consiste
à évaluer ces titres en degré français
(°F).
Il faut donc savoir que 1 équivalent = 5000 °F, donc 1
meq/L. = 5 °F (ou 1°F = 0,2 mé/L).
Le degré français est donc une unité de
concentration qui peut être utilisée comme le
mé/l pour exprimer la dose de tout sel soluble contenu dans
une eau. Très généralement utilisée il y
a quelques dizaines d'années, cette notation ne s'applique
plus guère qu'aux "titres" tels que TAC, TH, etc.
Son usage est cependant encore très répandu dans le
domaine du traitement d'eau par échange d'ions.
|
|
|
|
|
de CaCO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ou °Clark |
|
|
|
|
|
|
|
|
|
|
|
|
|
de CaCO3 |
|
|
|
|
|
1 °A = 0,83 °US ou 14,25 mg/l de CaCO3
-----------------
FACTEURS DE CONVERSION (MILLIGRAMMES EN MILLIEQUIVALENT ET INVERSEMENT)
|
Cations |
mg/l > méq/l |
mé/l > mg/l |
Anions |
mg/l > méq/l |
mé/l > mg/l |
|
Al+++ |
0,1111 |
8,993 |
BO2 - |
0,02335 |
42,82 |
|
Ba++ |
0,01456 |
68,68 |
Br - |
0,01251 |
79,92 |
|
Ca++ |
0,0499 |
20,04 |
Cl - |
0,0282 |
35,46 |
|
Cr+++ |
0,05768 |
17,34 |
CO3 -- |
0,03333 |
30,01 |
|
Cu ++ |
0,03148 |
31,77 |
CrO4 -- |
0,01724 |
58,01 |
|
Fe ++ |
0,03581 |
27,93 |
F - |
0,05263 |
19 |
|
Fe +++ |
0,0537 |
18,62 |
HCO3 - |
0,01639 |
61,02 |
|
H + |
0,9921 |
1,008 |
HPO4 -- |
0,02084 |
47,99 |
|
K + |
0,02558 |
39,1 |
H2PO4 - |
0,01031 |
96,99 |
|
Li + |
0,1441 |
6,94 |
HS - |
0,03024 |
33,07 |
|
Mg ++ |
0,08224 |
12,16 |
HSO3 - |
0,01233 |
81,07 |
|
Mn ++ |
0,03641 |
27,47 |
HSO4 - |
0,0103 |
97,07 |
|
Mn +++ |
0,07282 |
13,73 |
I - |
0,00788 |
126,9 |
|
Na + |
0,04348 |
23 |
NO2 - |
0,02174 |
46,01 |
|
NH4 + |
0,05543 |
18,04 |
NO3 - |
0,01613 |
62,01 |
|
Pb ++ |
0,009652 |
103,6 |
OH - |
0,0588 |
17,01 |
|
Sr ++ |
0,02282 |
43,82 |
PO4 --- |
0,03159 |
31,66 |
|
Zn ++ |
0,03059 |
32,69 |
S -- |
0,06237 |
16,03 |
|
SiO3 -- |
0,02629 |
38,05 |
|||
|
SO3 -- |
0,02498 |
40,03 |
|||
|
SO4 -- |
0,02082 |
48,03 |
Résidu
Sec (RS).
Le résidu sec (RS) - mesuré après
évaporation de l'eau filtrée et étuvée
(séchage) à 180°C- permet d'évaluer la
teneur en matières dissoutes. Il permet donc d'approcher la
valeur de la minéralisation. Il peut être déduit
de la valeur de conductivité (ou son inverse la
résistivité) :
- RS (mg/l) en fonction de la
conductivité (en microSiemens / cm)
:
- Si Si conductivité < 50 alors RS = 1.365079 x conductivité
- Si conductivité> 50 et <= 166 alors RS = .947658 x conductivité
- Si conductivité> 166 et <= 333 alors RS = .769574 x conductivité
- Si conductivité> 333 et <= 833 alors RS =.71592 x conductivité
- Si conductivité> 833 et <= 10000 alors RS = .758544 x conductivité
- Si conductivité> 10000 alors RS = .850432 x
conductivité
- RS (mg/l) en fonction de la
résistivité (en Ohm/cm) :
- Si résistivité> 20000 alors RS = 1365079 / résistivité
- Si résistivité> 6024 et <= 20000 alors RS = 947658 / résistivité
- Si résistivité> 3003 et <= 6024 alors RS = 769574 / résistivité
- Si résistivité> 1200 et <= 3003 alors RS = 715920 / résistivité
- Si résistivité> 100 et <= 1200 alors RS = 758544 / résistivité
- Si résistivité <= 100 alors RS = 850432 / résistivité
Nota :
Correspondance entre la résistivité (Ohm.cm) et la
conductivité (microSiemens / cm) :
- résistivité = (1 000 000 / conductivité),- conductivité = (1 000 000 / résistivité).
 (utiliser votre
navigateur)
(utiliser votre
navigateur)