|
|
(NaOH en léger excès, réaction fortement
exothermique DtH°298
= - 103 kJ/mole.
On obtient un mélange équimoléculaire
d'hypochlorite et de chlorure de sodium.
Les concentrations obtenues sont de 12,5 à 25 % de chlore
actif (dans ce dernier cas, NaCl précipite en partie et doit
être éliminé).
Nota.
Réaction parasite à ralentir le plus possible : 3 NaClO
>>> NaClO3 + 2 NaCl,
c'est-à-dire la formation de chlorates
NaClO3 et de chlorures, ceci est rendu possible en
maintenant la température du milieu aussi basse que possible
(ne doit pas dépasser 40°C).
Réaction du chlorure de chaux sur le carbonate de
sodium :
(solution claire de chlorure de chaux : mélange
CaOCl2 + CaCl2)
(le carbonate de calcium CaCO3 précipite)
Électrolyse d'une solution de sel : une
solution de saumure concentrée est fabriquée dans un
bac de dissolution avec du sel NaCl purifié. Cette saumure
passe ensuite dans un bac de production, ou un courant
électrique passant entre deux électrodes, va permettre
la production d’hypochlorite de sodium, selon les formules
chimiques :
L'eau de Javel produite est, en général, de faible concentration (< 1 % de chlore actif).
Remarques :
L'hypochlorite de sodium pur, sous forme de cristaux solides
(hydratés, en valeurs variables) présente peu
d'intérêt vu la faible stabilité de cette
substance.
Production.
SITUATION FRANÇAISE : production, environ 245 millions de
litres/an en grand public (ce qui représente
deux fois le volume des nettoyants ménagers).
Chaque jour ouvré, utilisation d'environ 1 million de
berlingots d'eau de Javel concentrée.
La France est au 2ème rang de la consommation
européenne en volume, derrière l'Espagne et juste
devant l'Italie (environ 220 millions de
litres/an).
Par ailleurs, la France est au 5ème rang de la
consommation mondiale en volume derrière :
Titres en chlore de l'eau de Javel.
Le degré chlorométriques
français °Cl (définition
encore utilisée essentiellement dans les pays francophones)
:
C'est le pouvoir oxydant d'un litre d'eau de
Javel à 20°C, exprimé en litres de dichlore
gazeux sec, sous 1 bar (1013 hPa) et
à 0°C.
Il correspond au dichlore gazeux Cl2 utilisé pour
fabriquer l'eau de Javel.
Or à T = 20°C, et P = 1 bar, 1 litre de Cl2
pèse 3,17 g (44,7 mmol) , donc
(Rappel : 1°Cl = 3,32 gNaClO/litre
[3.32
g.dm-3
]).
CETTE UNITÉ A ÉTÉ ABANDONNÉE EN 2001- LES
EAUX DE JAVEL FRANÇAISES DEVRAIENT MAINTENANT ÊTRE
DONNÉES EN % DE CHLORE ACTIF.
Attention : dans certains pays,
le °Cl est défini comme le nombre de litres de chlore
actif gazeux Cl2 (à 0°C et 760
mm Hg), contenu dans 1 litre de solution; donc dans ce cas le
°Cl = 3,214 g Cl2 actif/l.
Le % de chlore
actif :
Cette définition du titre d'une eau de Javel
(d'origine anglo-saxonne) a été
retenue au niveau européen en 1994. Il rend compte de la
quantité totale de dichlore Cl2 utilisé lors
de la fabrication de l'eau de Javel.
Toutefois, le % de chlore actif, pour une même qualité
d'eau de Javel, dépend de la masse volumique de l'eau de
Javel, qui elle même varie avec le mode de
préparation de l'eau de Javel.
En effet, l'eau de Javel préparée par dilution d'eau de
Javel à 100°Cl est moins dense (une partie des ions
Na+ et Cl- a été retirée)
qu'une eau de Javel préparée directement.
L'expression chlore actif est donc - malgré son utilisation
généralisée en Europe - impropre...
Les chimistes emploieraient plutôt l'expression "chlore
disponible".
Notons par ailleurs, qu'un excès d'ions HO-
(de 5 à 12 g/l exprimé en
NaOH) est maintenu dans la solution d'NaClO afin de
neutraliser l’influence du CO2 de l'air. En conséquence,
le pH d'une Eau de Javel concentrée peut être fortement
basique (pH = 11,5).
Il est donc nécessaire de connaître la relation entre
masse volumique et concentration pour convertir °Cl en %, qui de
plus peut varier selon les matières premières
utilisées car il existe deux matières premières
différentes :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota :
Table de
correspondance (pdf, 53 ko) à
télécharger (CSNEJ -
05/2010).
Produit commerciaux.
Jusqu'en 1976, l'Eau de Javel était stabilisée et
colorée en orangé à l’aide de bichromate de
sodium (environ 20 g pour 100 litres). Actuellement, l’Eau de
Javel commerciale est un liquide limpide, de couleur jaune vert,
ayant une odeur caractéristique dite « chlorée
» et une densité moyenne comprise entre 1,0 et 1,2.
Les solutions sont commercialisées sous deux formes
principales :
L'extrait concentré à 35°Cl n'est jamais
utilisé pur mais dilué au quart
(250 ml de Javel concentrée + 750 ml d'eau
distilée). On obtient donc une eau de Javel titrant
8,75 °Cl environ .
(*
g.dm-3
[g/L])
( Rappel : 1°Cl = 3,32 gNaClO.dm-3
[3.32 g/L]
).
Conservation : le concentré ne se conserve que
trois mois après fabrication, la solution à 9 °Cl
se conserve beaucoup mieux (6-12 mois). Il est donc conseillé
de diluer un concentré en voie de péremption. L'un
comme l'autre se conservent à l'abri de la lumière et
si possible à une température < à
25°C.
Nota : la dilution dans une bouteille de 1,5 litre, donne une
solution à 6°Cl (19 g de chlore actif par
litre ou 1,85%).
A noter également :
Propriétés physiques.
(de la solution équimoléculaire de NaClO + NaCl,
à 50°Cl)
Propriétés oxydantes :
elle se trouve d'autant plus oxydante que son pH est faible, mais
même à pH 14 son pouvoir oxydant reste
élevé (E° = 0,88 V).
Elle peut oxyder de nombreux composés toxiques en
composés "inoffensifs", tels que par exemple :
Son action décolorante, en partie, due à sa capacité d'oxyder de nombreux composés organiques.
Propriétés
désinfectantes :
Elles sont dues au pouvoir bactéricide de l'acide
hypochloreux qui diffuse à travers la paroi des cellules des
bactéries en détruisant des protéines
membranaires.
Par ailleurs, HClO agit sur le métabolisme de synthèse
des bactéries. HClO, non chargé, est près de 100
fois plus bactéricide que l'ion hypochlorite.
Dans le cas des virus, HClO agirait par attaque des liaisons
amidées des protéines.
A la demande de la Chambre Syndicale Nationale de l'Eau de
Javel (CSNEJ), l'Institut Pasteur de Lille a
réalisé en 2008 un essai se basant sur la norme
européenne EN 14476 afin de déterminer
l'activité virucide de l'Eau de Javel à 2,6 % de chlore
actif sur le virus Influenza virus A/H5N1.
Les résultats montrent que l'Eau de Javel possède une
activité virucide sur le virus de la grippe aviaire
A/H5N1.
Dans les conditions suivantes :
La concentration efficace est de 0,10 % de chlore actif.
Ce qui correspond à l'Eau de Javel du commerce en
flacon diluée environ 25 fois.
Propriétés chimiques.
L'hypochlorite de sodium NaClO (ou Oxychlorure
de sodium) de masse moléculaire : 74.44,
(sel de l'acide hypochloreux HClO), dissous
dans l'eau donne l'eau de Javel.
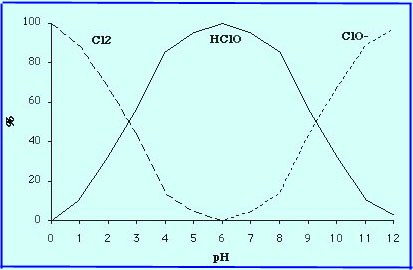
Lorsque l'on injecte une solution d'hypochlorite de soude
[Na+][ClO-] dans l'eau, aux
valeurs de pH des eaux habituellement rencontrées (5.5
à 9), tout ou partie de l'ion [ClO-] se
transforme en acide hypochloreux HClO :
Notons donc par que 1 millimole d'hypochlorite "consomme" 1
méq de CO2, et génère 1 méq
d'alcalinité (TAC), ce qui devrait
élever légèrement le pH
.
Formes chlorées en fonction du pH :

donc l'hypochlorite de sodium a les mêmes pouvoirs que le
chlore gazeux.
Stabilité :
Utilisations.
Usage domestique : (50 %), pour son action en
désinfection (HClO est bactéricide, fongicide, virucide
et sporicide), et de son pouvoir blanchissant, et en particulier des
eaux de piscines :
Pharmacie : les liqueurs de Dakin et
deLabarraque sont à base d'eau de Javel.
L'eau de Javel permet de désinfecter le matériel
(seringues…) contaminé par le virus du Sida.
Toxicité : la dose mortelle pour l'homme est estimée
à 120 - 200 g d'eau de Javel ingérée.
Traitement de potabilisation :
Selon le pH de l'eau, l'eau de Javel donnera un mélange
de HClO et de ClO-.
Ce traitement, si présence de matières organiques,
peut, par formation de composés organochlorés tels que
le chloroforme, donner à l'eau un goût
désagréable.
Pour le limiter, en France, la chloration est de 0,2 à 0,3
mg/l.
La concentration maximale admissible fixée par l'O.M.S. est de
5 mg/l.
A New York par exemple, elle varie entre 0,7 et 2 mg/l, le goût
d'eau de Javel y étant considéré comme le gage
d'une eau saine.
Le tableau comparatif suivant rassemble montre les
caractéristiques de l'eau de Javel (ou du chlore)
et de l'ozone :
|
|
|
|
de mortalité |
virus : 1 amibes : 0,05 ---- durée : 45 min |
virus : 5 amibes : 0,5 ---- durée : 4 min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A des concentrations inférieures aux doses létales,
l'eau de Javel inhibe le développement des bactéries ce
qui permet la protection de l'eau potable lors de son transport par
canalisations.
Industriellement :
L'eau de Javel est utilisée, en particulier, pour
éviter le développement des algues et des mollusques,
dans les canalisations des usines de dessalement de l'eau de mer et
dans les circuits de refroidissement des centrales thermiques
classiques ou nucléaires utilisant l'eau de mer.
Par exemple, la centrale de Graveline utilise, lorsque la
température de l'eau de mer dépasse 10°C,
utilise 0,8 mg de Javel par litre d'eau de mer.
Évidemment, en raison notamment de son action son
antiseptique, elle est très utilisée pour tous
nettoyages à usage désinfectant.
Stockage :
Par suite du dégazage du chlore, pour éviter les
désamorçages des pompes doseuses de distribution, des
évents sont à prévoir sur les conduites
d'aspiration et de refoulement.
Elle peut être livrée par touries, containers, ou
par camions-citernes.
Informations
écologiques
: ne pas évacuer dans les eaux
naturelles, les eaux d'égout ou le sol !
COMPOSES CONTENANT DES IONS HYPOCHLORITES :
L'eau de Javel se présente en solution. Il existe des
composés renfermant des ions hypochlorites se
présentant sous forme solide. Il s'agit principalement :
 (utiliser votre navigateur)
(utiliser votre navigateur)